Frühe Nutzenbewertung - Cemiplimab beim fortgeschrittenen nichtkleinzelligen Lungenkarzinom (NSCLC)
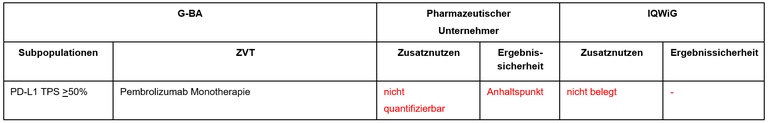
Die frühe Nutzenbewertung von Cemiplimab ist ein weiteres Verfahren zur Erstlinientherapie beim fortgeschrittenen nichtkleinzelligen Lungenkarzinom (NSCLC). Cemiplimab ist als Monotherapie zugelassen zur Erstlinientherapie von Patient*innen mit nicht-kleinzelligem Lungenkarzinom (NSCLC), die eine PD-L1 Expression ≥ 50 % auf den Tumorzellen und keine EGFR-, ALK- oder ROS1-Aberrationen aufweisen. Indiziert ist Cemiplimab sowohl für Patient*innen mit lokal fortgeschrittenem NSCLC, die keine Kandidaten für eine definitive Radiochemotherapie sind, oder für Patient*innen mit metastasiertem NSCLC. Der G-BA hat das IQWiG mit dem Bericht beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zu unterschiedlichen Bewertungsvorschlägen. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
Unsere Anmerkungen sind:
- Bei Patient*innen mit einem fortgeschrittenen/metastasierten NSCLC, hoher PD-L1 Expression der Tumorzellen und fehlender Indikation für eine molekular gezielte Therapie bestehen zwei Therapieoptionen:
- Immuntherapie: Monotherapie mit einem Immuncheckpoint-Inhibitor (ICI); vom G-BA wurde hier Pembrolizumab als zuerst zugelassenes Arzneimittel in dieser Indikation als ZVT festgelegt.
- Immunchemotherapie: Kombination von Immuncheckpoint-Inhibitoren mit einer platinhaltigen Chemotherapie; Dieser Komparator fehlt in der festgelegten ZVT.
- Basis der frühen Nutzenbewertung ist EMPOWER-Lung 1 (R2810- ONC-1624), eine internationale, randomisierte, offene Phase-III-Studie zum Vergleich von Cemiplimab gegenüber einer platinhaltigen Chemotherapie. Deutsche Zentren waren an der Studie nicht beteiligt.
- Cemiplimab führte gegenüber einer platinhaltigen Chemotherapie zur Steigerung der Remissionsrate, zur Verlängerung der progressionsfreien Überlebenszeit und zur Verlängerung der Gesamtüberlebenszeit. Die Crossover-Rate aus dem Chemotherapie- in den Cemiplimab-Arm war sehr hoch. Eine differenzierte Darstellung der Folgetherapien und des möglichen Einflusses auf die Studienendpunkte fehlt im Dossier.
- Cemiplimab führte zur Reduktion der Rate schwerer Nebenwirkungen. Die Mehrzahl der Unterschiede bei den Parametern von PRO mit Bezug zur Morbidität und zur Lebensqualität sind auf die Reduktion der Nebenwirkungen zurückzuführen.
- In der Bewertung des klinischen Nutzens auf der ESMO-Magnitude of Clinical Benefit Scale v1.1 erhält Cemiplimab gegenüber platinhaltiger Chemotherapie den Grad 4 (Skala 1 (niedrig) – 5 (hoch)).
Mit Cemiplimab steht jetzt ein weiterer Immuncheckpoint-Inhibitor für die Erstlinientherapie von NSCLC-Patient*innen mit hoher PD-L1 Expression zur Verfügung. Daten zum direkten Vergleich mit anderen Immuncheckpoint-Inhibitoren liegen nicht vor. Wichtig ist die Möglichkeit des zusätzlichen Einsatzes von Cemiplimab bei Patient*innen im Stadium III (B,C) mit hoher PD-L1 Expression, die nicht mit einer definitiven Radiochemotherapie (multimodalen Therapie) behandelt werden können.



