Frühe Nutzenbewertung - Ripretinib beim Gastrointestinalen Stromatumor (GIST)
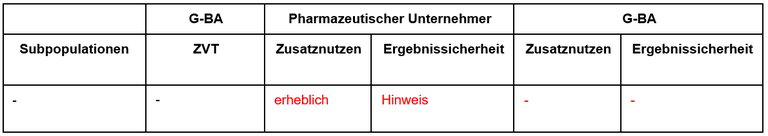
Diese frühe Nutzenbewertung von Ripretinib (Qinlock®) ist das dritte Verfahren zu einem neuen Arzneimittel bei gastrointestinalen Stromatumoren (GIST). Ripretinib ist zugelassen zur Therapie von Patient*innen mit fortgeschrittenen GIST, gastrointestinalen Stromatumoren (GIST), die zuvor eine Behandlung mit drei oder mehr Kinase-Hemmern, einschließlich Imatinib, erhalten haben. Aufgrund des Orphan-Drug-Status wurde der Bericht vom G-BA erstellt. Subgruppen, zweckmäßige Vergleichstherapie sowie die unterschiedlichen Bewertungsvorschläge sind in Tabelle 1 zusammengefasst.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
Unsere Anmerkungen sind:
- Viele Patient*innen mit fortgeschrittenen, gastrointestinalen Stromatumoren (GIST) sind auch im Progress nach >3 Vortherapien mit Kinase-Inhibitoren in gutem Allgemeinzustand. Hier besteht ein ungedeckter medizinischer Bedarf. Für die Evaluation neuer Arzneimittel ist eine Placebo-kontrollierte Studie auf der Basis von Best Supportive Care angemessen.
- Ripretinib ist ein sogenannter Switch-Control-TKI mit einem dualen Wirkmechanismus. Ripretinib inhibiert den KIT- und auch den PDGFRA-Kinase-Signalübertragungsweg.
- Basis der frühen Nutzenbewertung von Ripretinib ist die INVICTUS Studie, eine internationale, randomisierte Phase-III-Studie zum Vergleich von Ripretinib vs Placebo. Die Randomisierung erfolgt 2:1 zugunsten des Verum-Arms.
- Ripretinib führte zu einer statistisch hoch signifikanten Verlängerung des medianen progressionsfreien Überlebens und der medianen Gesamtüberlebenszeit sowie der Überlebensrate nach 24 Monaten. Die Ansprechrate ist mit ca. 10 % vs. 0% bemerkenswert, jedoch knapp nicht signifikant erhöht.
- Die Rate schwerer Nebenwirkungen im Grad 3/4 ist niedrig.
Für Patient*innen mit progredientem GIST nach Vortherapie mit mindestens 3 Kinase-Hemmern ist Ripretinib jetzt die Therapie der Wahl.



