Frühe Nutzenbewertung: Luspatercept bei der nicht-transfusionsabhängigen Beta-Thalassämie
Die frühe Nutzenbewertung von Luspatercept (Reblozyl®) betrifft ein neues Anwendungsgebiet. Luspatercept wurde jetzt zugelassen zur Behandlung von Patientinnen und Patienten (Pat.) mit nicht-transfusionsabhänger Anämie bei Beta-Thalassämie. Der G-BA hat keine Subpopulationen gebildet. Das IQWiG wurde mit der Dossierbewertung beauftragt. Pharmazeutischer Unternehmer und IQWiG kommen zur gleichen Bewertung. Einen Überblick über Vergleichstherapie und Bewertungsvorschläge gibt Tabelle 1.
Tabelle 1: Berechnung des Zusatznutzens durch pU und IQWiG
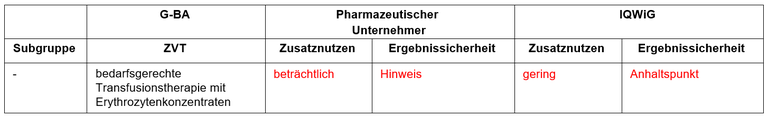
pU – pharmazeutischer Unternehmer; ZVT – zweckmäßige Vergleichstherapie;
Unsere Anmerkungen sind:
- Standard bei Pat. mit nicht-transfusionsabhängiger Beta-Thalassämie ist eine supportive Therapie mit Symptom-abhängiger Transfusion von Erythrozytenkonzentraten. Dem entspricht die für dieses Verfahren festgelegte zweckmäßige Vergleichstherapie.
- Basis der frühen Nutzenbewertung ist BEYOND, eine randomisierte, Placebo-kontrollierte Phase-II-Studie zum Vergleich von Luspatercept gegenüber Placebo.
- Luspatercept führte zur Steigerung des Hämoglobingehaltes, zur Senkung der Transfusionsfrequenz von Erythrozytenkonzentration und zur Verbesserung von Parametern der Lebensqualität.
- Die Rate schwerer unerwünschter Ereignisse wurde durch Luspatercept nicht signifikant gesteigert. Das Muster der Nebenwirkungen entspricht den bisherigen Erfahrungen.
Luspatercept ist eine Therapieoption bei Pat. mit nicht-transfusionsabhängiger Beta-Thalassämie. Die individuelle Entscheidung zum Einsatz wird durch die klinische Symptomatik und die Transfusionshäufigkeit bestimmt.



